نانومواد به عنوان انتقالدهندههای ژنی غیرویروسی (قسمت دوم) :
بیان مواد ژنتیکی نظیر DNA, RNA به سلولها وبافتها امیدهای قابل توجهی را برای اهداف درمانی و تشخیصی ایجاد کرده است. اما وارد کردن نوکلوئیک اسیدها به درون سلول، با چالشهایی نیز مواجه میشود. این چالشها برای حاملهای غیرویروسی به عنوان شیوه ی حمل ژن و دارو، به نسبت انواع حاملهای ویروسی یا حمل آزاد،کمتر بوده و لذا به صورت کم خطرترو مناسبتر مورد توجه قرارگرفته اند. در ادامه بحث نانوحاملهای غیرویروسی در حال گسترش، به مواردی چند از این نانوحاملها مثل پلی لیزین، پلی اتیلن آمین، پلی لاکتیک کوگلیکولیک اسید، سیلیکا، همبسپارهای دستهاى، نقاط کوانتومی، نانوذرات طلا و نانوتیوبهای کربنی خواهیم پرداخت. ما در این مقاله به دنبال ارائه راهکارهایی برای بهبود برداشت سلولی سیستمهای حامل غیرویروسی و بیان چشماندازهای استفاده از این حاملها هستیم.
مقدمه
ژن درمانی دارای پتانسیل برای درمان کردن بیماری های انسانی است که از ژنهای معیوب ایجاد می شوند. تعدادی از این بیماری ها شامل فیبروز کیسه ای،degeneration macular ، بیماری پارکینسون و انواع سرطان های مختلف می شود. همچنین ژن درمانی برای بیان ژنهای مختلف و یا برای خاموشکردن آنها در بافتهای حیوانی از قبیل سیستم عصبی مرکزی، ریه، کبد و غیره بکارگرفته شده است. توسعه موثر ژن درمانی به انتقال کارامد ژنهای درمانی به سلول، برای جابه جا کردن یا ساکت کردن موارد معیوب تولید کننده بیماری در انسان، مربوط میشود. معمولا ناقلهای ویروسی مثل ادنو ویروسها و رتروویروسها به دلیل کارایی بالایی که در تحویل ژن دارند، در ژن درمانی مورد استفاده قرار می گیرند. اما بروز برخی مشکلات منجر به بازبینی دراستفاده از ناقلهای ویروسی در تستهای کلینیکی برای انسان شده است. اخیرا ذرات غیر ویروسی در ژن درمانی مورد توجه گسترده قرار گرفته اند. این توجه به این خاطر است که آنها می توانند بر انواع سمیت ناشی از تحویل ویروسی فائق آیند. برخی از ناقل های غیر ویروسی رایج که اجازه عبور ماده ژنتیکی از بین سدهای سلولی را می دهند در این مقاله مطرح شده اند.
۴-۳- پلی لیزین و پلی اتیلن آمین
پلی ال لیزین (شکل ۷) یکی از اولین پلیمرهای مورد استفاده در ژن رسانی است.زیست تخریبپذیری بالا و البته سمیت بالایی نیز دارد که کاربرد درون تن آن را محدود میکند. مطالعات اولیه بیان میکنند که اگر از پلیلیزین با وزن مولکولی مناسب و نسبت بار مناسب استفاده شود میتوان نانوذرات ۱۰۰ نانومتری ساخت که به مقدار کم توسط سلول برداست میشوند. علت این امر کمبود گروه آمین در سطح ذره (بار مثبت کم) بیان شده است. البته با استفاده از گروه های هدفگیری سلولی و نیز عوامل لیز آندوزومی از قبیل Chloroquine میتوان این نقص برداشت انتقال ژن کم را برطرف کرد. در تلاش برای بهبود کارایی انتقال ژن و کاهش سمیت،Lee و همکارانش حاملی را با استفاده از اتصال پلی اتیلن گلیکول (PEG= Poly Ethylene Glycol) به پلی لیزین و نیز Fusogenetic peptide سنتز کردند. در این روش ابتدا PEG به پلی لیزین متصل شده و سپس با DNA برهمکنش میدهد و در ادامه با پپتید فوزوژنیک متصل میشود. ذرهی حاصل دارای بار مثبت بوده و در نتیجه ذرات حاصل پایداری خوبی دارند و البته استفاده از PEG و پپتید باعث کاهش سمیت و افزایش بهبود انتقال ژن میشود.
پلی اتیلن ایمین (PEI) (شکل ۷) نخستین حامل انتقال ژن کشف شده است و بنابراین تاکنون مطالعات بسیاری بر روی آن صورت گرفته است. البته سمیت پلی اتیلن ایمین بزرگترین نقص این حامل میباشد. مقالهای Kircheis و همکارانش در ارتباط با طراحی و سنتز PEI اصلاح شده برای ژن رسانی بسیار جامع است و بر اصلاح سطحی PEI ، غلظتDNA، اندازهی ذره، برداشت سلولی ذره ، فرار آندوزومی، ژنرسانی درون تن و بسیاری دیگر از جنبههای مرتبط تمرکز دارد .
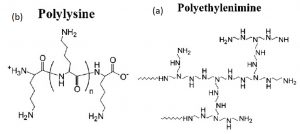
شکل ۷- ساختار پلی اتیلنایمین(a) و پلی لیزین(b)
Sagara و Kimاستفاده استفاده از ترکیب گالاکتوز، پلی اتیلن گلیکول و پلی اتیلن ایمین (Glc-PEG-PEI)را برای ژن رسانی به سلولهای هپاتوسیت گزارش کردند و انتقال بهتر این سیستم را نسبت به حامل مشابه PEI نشان دادند. آنها این سیستم را سیستمی مناسب برای ژن رسانی کبدی معرفی میکنند. Rudolph و همکارانش استفاده از PEI پوشانده شده با PEG برای انتقال DNA به ریه از طریق استفاده از نبولایزر (nebulizer) و یا تزریق تراکئال(intratracheal ) را گزارش کرداند.نویسنده گزارش کرده که استفاده از وزن مولکولی بالای PEG باعث کاهش کارایی انتقال ژن میشود و این امر میتواند به علت ممعانعت فضایی PEG برای برهمکنش حامل با ذره باشد.
۵-۳- پلی لاکتیک کوگلیکولیک اسید (PLGA= Poly(lactide-co-glycolide
برای کاربردهای دارورسانی و ژن رسانی پلیمر های گوناگونی بکار گرفته شدهاند اما (PLA=poly(lactic acid و PLGA تنها پلیمرهای تایید شده توسط FDA هستند که بسیار مورد توجهاند. روش تبخیر حلال امولسیون ( emulsion-solvent evaporation) به عنوان یکی از رایج ترین روشهای سنتز ذرات PLA و PLGA مد نظر است و در این روش پلی وینیل الکل(PVA) به عنوان پایدارکننده (Stabilizer) معمول بکار میرود. با این تکنیک هم ذرات بزرگ و هم ذرات کوچک بدست میآیند و در صورتی که از غشاهای دیالیز ۱۰۰ نانومتری استفاده کنیم، ذرات ریز با اندازه میانگین ۲± ۷۰ نانومتر را جدا می شوند و ذرات عبور نکردهی بزرگتر دارای میانگین اندازهی میانگین ۹± ۲۰۲ نانومتر هستند.ذرات کوچکتر ۲۷ برابر ذرات بزرگتر در انتقال ژن به سلولهای Cos-7و ۴ برابر در سلولهای HEK-293 کارا هستند. بار سطحی،برداشت سلولی و آزادسازی DNA هر دو گروه تقریبا برابر است.
دیگران مطالعاتی بر روی نقش باقیماندهی PVA بر روی برداشت سلولی و نیز بر روی نانوذرات PLGA داشته اند. حذف PVA در حین فرآیند آمادهسازی بسیار سخت است، بنابراین مقداری از PVA با ذرات باقی خواهد ماند که این PVA باقی مانده به مقدارPVA اولیه، نوع حلال آلی مورد استفاده در امولسیون وچندین عامل دیگر بستگی دارد. PVA بر روی اندازه ذره، پتانسیل زتا، شاخص پلی دیسپرسیتی Poly dispersity factor (PDI) و آبگریزی سطح نانوذره تاثیر میگذارد. ذرات با PVA باقیماندهی زیاد با اینکه اندازهی کوچکتری دارند ولی برداشت سلولی کمی نیز دارند که این امر میتواند ناشی از کاهش هیدروفوبیسیتهی بیشتر سطح نانوذرات باشد.
۶-۳- سیلیکا
استفاده از نانوذرات سیلیکا برای کاربردهای ژن رسانی زیاد مورد توجه قرار نگرفته است. در یک سری از مطالعات نشان داده شده که ذرات سیلیکا با بار مثبت سطحی توانایی برهمکنش با DNA پلاسمیدی و بکارگیری در انتقال ژن به صورت برون تن را دارند. این ذرات از طریق تغییر سطح سیلیکای موجود در بازار تهیه شده اند. در مقایسه با ذرات PEI سمیت خاصی برای این ذرات در غلظتهای موردنیاز دیده نمیشود.
۷-۳- همبسپارهای دستهاى (Block Copolymers)
همبسپار دستهاى ترکیبی از بخش کاتیونی و بخش آبگریز اند که به صورت خودسامان با DNA پلی آنیون واکنش میدهند و مایسل هایی را میسازند. Kataoka و همکارانش پیشروهای این حیطه از تحقیق اند. آنها جنبه های گوناگون ساخت این همبسپارهای دستهای کاتیونی، خواص فیزیکوشیمیایی و جنبههای بیولوژیکی از قبیل برداشت سلولی و فرار آندوزمی را بررسی کردهاند.
۸-۳- نقاط کوانتومی
Burgess و همکارانش نشان دادند که DNA پلاسمیدی را میتوان به صورت کوالان به نقاط کوانتومی متصل کرد. آنها نقاط کوانتومی را با TOPO=triocytylphosphine oxide و TOP=triocytylphosphine کپسوله کرده و سپس با استفاده از اتصالدهنده (linker) ملامید که حاوی پیوند دیسولفیدی است، نقاط کوانتومی را به DNA پلاسمیدی متصل کردند. این سیستم سمیت بسیار کم و رسانش بالای DNA به هستهی سلول را نشان داد. Bhatia و همکارانش نیز با استفاده از عامل فرار آندوزومی (endosome escape agent) (لیپوفکتامین) siRNA را به نقاط کوانتومی متصل کردند و توانستند ژن EGFP(Enhanced green fluorescent protein) را تا ۲۹ درصد خاموش کنند.
۹-۳- نانوذرات طلا
استفاده ازDNA پوشیده شده بر روی نانوذرات فلزی (برای انتقال ژن) در ابتدا به وسیلهی دستگاههای شتابدهندهی ذرهای (particle accelerationdevices) (تفنگ ژنی) صورت گرفت. در مطالعات اولیه،DNA بروی نانوذرات تنگستن رسوب داده شد و این نانوذرات بروی ذرات بزرگ پلیپروپیلن قرار گرفتند. از فشار انفجاری دستگاه برای هل دادن ذرات استفاده میشود و ذرات بزرگ در انتهای لولهی دستگاه بر روی دیسک پلی کربناتی گیر میکنند در حالیکه نانوذرات تنگستن از دیسک عبور کرده و به سلولها وارد میشوند. مدتی بعد از دستگاههایی با فشار گاز هلیم که ایجاد یک شوک موجی میکردند برای انتقال نانوذرات طلا به داخل بافتها استفاده میشد. این دستگاهها باعث انتقال ۴ برابری ژن لوسیفراز در پوست موش در مقایسه با دستگاههای سری قبل میشدند، اما شوک ایجاد شده توسط فشار گاز هلیم میتوانست باعث صدمهی سلولی شود. بنابراین در مدلهای بعدی از فشار گاز هلیم برای پرتاب گلولهای استفاده میشد، فشار حاصل از پرتاب گلوله باعث متوقف شدن گلوله بر روی دیسکی که در انتهای لولهی دستگاه قرار داشت میشد ولی مانند نمونههای قبلی که از فشار گاز هلیم استفاده نمیکرند ذرات DNA به آن طرف دیسک پرتاب میشدند که باعث کمترین آسیب ممکن به سلولها میشد.
علاوهبر این، تفنگهای تخلیه قوس الکتریکی (arc-discharge guns ) نیز به عنوان شتابدهندهی ذرهای استفاده شدهاند. در این سیستمها ذرات طلا پوشیده شده بر روی یک فیلم میلار(Mylar film ) (لایه پلی استری) وجود دارند. قوس الکتریکی ایجاد شده توسط دو الکترود باعث شتاب دادن فیلم بر روی یک پرده میشود. فیلم بر روی پرده متوقف میشود ولی ذرات طلا از پرده عبور کرده و به سلولها میرسند. با این روش حجم ذرات انتقال دادهشده توسط دستگاه را میتوان با تغییر ولتاژ، دانسیته ذرات طلا –DNA و یا اندازهی ذرات تغییر داد. بمباران ذرهای از روشهای اولیه انتقال DNA میباشدکه میتوان از آن برای کاربردهای ایمنیسازی استفاده کرد.
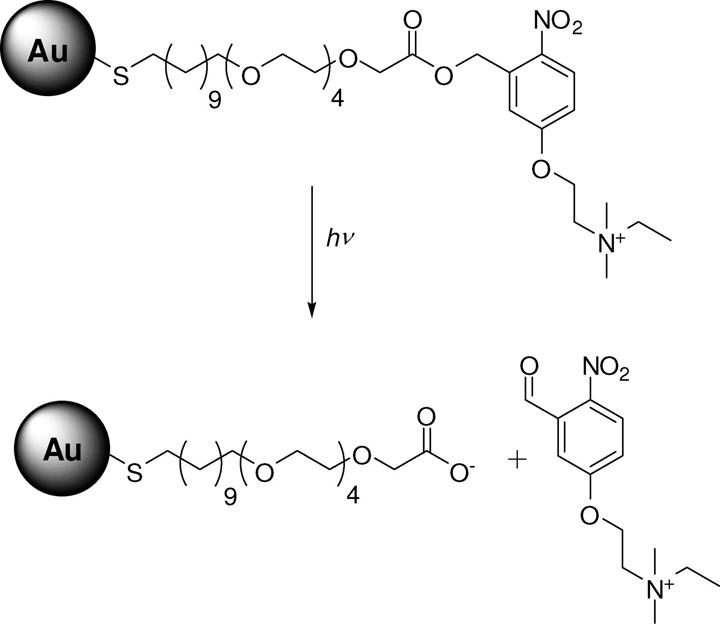
اخیرا محققان به فکر تغییر سطح نانوذرات طلا برای انتقال آندوسیتوزی آنها به سلول هستند. Rotello و همکارانش با واکنش آلکانوتیولها با نانوذرات طلای ۲ نانومتری خوشههای پوشیدهشدهی تک لایهای (MMPCs = mixed monolayerprotected gold clusters) را سنتز کردند(شکل۸). خوشههای با بار مثبت بیشترین قابلیت انتقال ژن را داشتند(۶۸%).این گروه نشان دادند که قابلیت انتقال ژن با طول زنجیرهی آلکیلی نسبت مستقیم دارد. Klibanov و همکارانش نانوذرات طلای کانژوکه شده باPEIرا سنتز کردند. ذرات سنتز شده قابلیت انتقال ژن ۱۵ تا ۶ برابری را نسبت به ذرات PEI را داشتند، البته سمیت این ذرات نیز بیشتر از ذرات PEI بود.
Rosi و همکارانش اولیگونوکلتیدهای آنتیسنس با گروههای تیولی را به نانوذرات ۱۳ نانومتری طلا متصل کردند و نتایج خوبی برای خاموشی ژن EGFP گرفتند. به منظور بهبود انتقال بهتر اولیگونوکلئتیدها با نانوذرات، تلاشهایی برای ساخت ترکیباتی از نانوذرات و DNA با اتصالات ناپایدار، شده است که این اتصالات در سیتوپلاسم سلولی شکسته میشوند و رشتهی اولیگونوکلتیدی از نانوذره جدا میشود. به این منظور در یکی از روشها با افزایش غلظت گلوتاتیون داخل سلولی امکان آزاد سازی رشتهی اولیگونوکلوتیدی که با اتصال تیولی به ذره متصل شده است فراهم میآید.
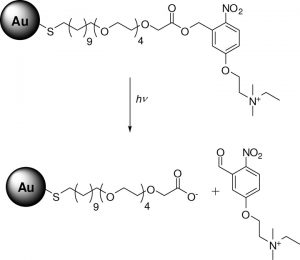
شکل ۸- نانوذرات فلزی طلا متصل شده به گروههای تیولی مختلف
۱۰-۳- نانوتیوبهای کربنی
استفاده از نانوتیوبهای کربنی برای ژن درمانی مربوط به سالهای اخیر است. این ساختارهای کربنی به شدت نامحلولاند و تکنیکهای عاملدار کردن (techniques Functionalization)کووالان و غیرکووالان جهت افزایش حلالیت این ساختارها گسترش یافته است. عاملدار کردن کووالان شامل دو روش است. اکسیداسیون نانوتیوبهای کربنی در شرایط اسیدی باعث تولید انتهاهای اسیدی میشود. عامل دار کردن غیر کووالان به طور معمول دربرگیرنده برهمکنشهای هیدروفوبیک و یا پای-پای بین نانوتیوب کربنی و سورفاکتانت، اسیدآمینه و یا رشته نوکلوتیدی است(شکل ۹).
Bianco و همکارانش از نانوتیوبهای کربنی که به صورت کووالان به گروههای عاملی کاتیونی متصل شده اند برای اتصال DNA استفاده کردهاند. برداشت سلولی این ترکیبات حاوی DNA در ردهی سلولی Hella از طریق آندوسیتوز بود.نتایج میکروسکوپی نشان داده است که اتصال DNA به نانوتیوبهای کربنی چنددیواره بسیار قویتر از اتصال DNA به نانوتیوبهای تکدیواره است.
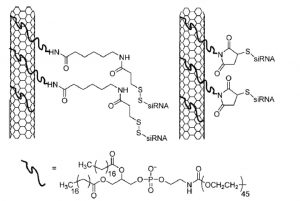
شکل ۹- نمای شماتیک عاملدار کردن نانوتیوبهای کربنی با زنجیرههای فسفولیپید – PEG که متاقبا به siRNA متصل شدهاند.
مطالعات زیادی برای انتقال siRNA به سلول و خاموش کردن یک ژن خاص با استفاده از نانوتیوبهای کربنی صورت گرفته است. Dai و همکارانش از نانوتیوبهای عامل دار شده با فسفولیپید-PEG برای واکنش با siRNA دارای انتهای تیول استفاده کردند. آمین انتهایی زنجیرهی متصل به نانوذره به گروه سولفور متصل به DNA واکنش میدهد. این ساختارها توانایی رسانش siRNA و خاموش کردن ژن بسیار خوبی را نشان دادهاند. تستهای درون تن که با نانوتیوبهای کربنی صورت گرفته نیز چشمانداز روشنی را برای این روش بیان میکند.
۴- راهکارهایی برای بهبود برداشت سلولی سیستمهای حامل غیرویروسی
ژن رسانی غیرویروسی برای بیان ژنهای مختلف و یا برای خاموشکردن آنها در بافتهای حیوانی از قبیل سیستم عصبی مرکزی،ریه، کبدو غیره بکار گرفته شده است. میزان رسانش ژن با این حامل ها در مقایسه با حاملهای ویروسی اغلب ناکافی است و بقای ژن نیز در شرایط درون تن اغلب ضعیف است. پیشرفتهای بیشتر در فنآوری ژن رسانی غیرویروسی میتواند کاربردهای آنرا گسترش دهد و جانشین مطمئنی را برای حاملهای ویروسی فراهم آورد. برای درمانهای درون تن بسیار مهم است که حامل را برای یک سلول مشخص هدفمند کنیم تا از تاثیرات بر سایر بافتها و سلولهای غیر هدف جلوگیری کنیم. هدفمند کردن اغلب به صورت فعال (Active tageting )برای یک سری از سلولها صورت میگیرد. ولی در بعضی از موارد وابسته به شرایط فیزیولوژیک هدفمند کردن حامل به صورت غیر فعال (Pasive targeting) نیز صورت میگیرد.برای مثال وجود منفذهای نامنظم در بافت اندوتلیال رگهای توموری (Irregular endothelial fenestration ) امکان ورود نانوذرات با اندازه و یا ترکیب خاص را قراهم میآورند(EPR effect ). برای ایجاد هدفگیری فعال در شرایط درون تن، حامل بایستی برهمکنشهای غیراختصاصی را از طریق پوشانده شدن با پوشش پلیمری مانند PEG به حداقل برساند و دارای عوامل هدفگیری مختص سلولهای خاص باشد. لیگاندهای مختلفی برای این کار استفاده میشود که بسته به ساختار و نوع سلول هدف میتواند شامل فولات، ترانسفرین، EGF(Epithelial growth factor) ، FGF(Fibroblast growth factor) ،وآفیبادی، نانوبادی، آنتی بادیهای مختلف باشند.
۵- چشمانداز حاملهای غیرویروسی
امروزه تحقیقات ژن رسانی در جستجوی حاملهای بهتری است که با ویژگیهای بیمار و نوع بیماری همخوانی داشته باشند. بنابراین احتمال طراحی حاملهای خاص برای بیماریهای گوناگون در آینده زیاد است. برای اکثر بیماریهای ژنتیکی نیاز به حاملهایی است که بتوانند ژنهایی با اندازهی متوسط و بزرگ را انتقال دهند. تزریق ژن تنها مشکل پیش رو در ژن رسانی نیست در بعضی از موارد حامل بایستی شرایطی را فراهم آورد که ژن در بافت هدف فعال شود. بنابراین حامل بایستی دارای دستگاهِ تنظیمی باشد که اجازهی روشن و خاموش کردن ژن و تغییرات سطح پروتئین درمانی را را برای پزشک فراهم آورد. از جملهی این ابزار ها میتوان به پروموتورهایی با اندازهی بزرگ و شکل پیچیده اشاره کرد که البته قرارگیری این پروموتورها در وکتور یک مشکل اساسی است. بسیار واضح است که در آینده پلیمرها نقش اساسی در پیشبرد حاملهای ژنرسانی دارند با انتخاب وزن مولکولی مناسب، آنها را میتوان برای کاربردهای خاص بهینه کرد. با اتصال عوامل هدفگیری بافت و یا سلولهای خاص ویا سایر تغییرات میتوان خواص زیستی و فیزیکو شیمیایی آنها را بهبود داد. بعد از آگاهی کامل از ساختار حامل مناسب، صنعتی سازی ساخت حامل معمولا آسان است البته کاملا روشن است که انجام تمامی این موارد تنها برای حاملهای غیرویروسی امکانپذیر است.
نتیجهگیری
آنچه در این مقاله به آن اشاره شد، انواع حاملهای غیر ویروسی، ازحاملهایی نظیر پلیمرهای کاتیونی مثل پلی لیزین، پلی اتیلن آمین و PLGA گرفته تا نانوذرانی از سیلیکا،همبسپارهای دسته ای، نقاط کوانتومی، نانوذرات طلا و نانولوله های کربنی هستند. در اکثر موارد اشاره شده، به معرفی ساختار حامل و دلایل استفاده از آن، همچنین به موارد عملی بارگیری، اصلاح سطح و بررسی های درون تن و برون تن برخی، اشاره شد. راهکارهایی که برای بهبود برداشت سلولی این حاملها مطرح شد شامل بهره بردن از هدفمند کردن به شکل فعال وغیر فعال، می باشد. چشم اندازهای استفاده از حاملهای ویروسی اخرین مبحثی است که به آن پرداخته شده است. در اینجا ایده الهای مد نظر در ژن درمانی مطرح شده و دستیابی به نوعی از حاملهایی که با ویژگیهای بیمار و نوع بیماری قابل تطابق هستند، جزء آرمانهای این رشته، مطرح میشود. در این خصوص زمزمه های طراحی حاملهای خاص برای بیماریهای مختلف به گوش می رسد.
منبع : edu.nano.ir