نانومواد به عنوان انتقالدهندههای ژنی غیرویروسی ( قسمت اول ) :
ژن درمانی امید ها را برای درمان گستره زیادی از بیماری ها مانند سرطان زنده نگه می دارد و نانوذرات در این بین به عنوان حامل های امید بخش برای انتقال موثر و ایمن ژن ها به سلول ها یا بافت های ویژه شناخته می شوند. این موضوع می تواند راهکار های درمانی جایگزین را برای رویکرد های معمول که از ویروس ها به عنوان حامل های ژن استفاده می کنند فراهم کند. در این مقاله ژن رسانی معمول و مشکلات آن، کاربرد انواع نانوذرات مانند نانوذرات پلیمری، لیپوزوم ها، ذرات لیپیدی جامد، در انتقال هدفمند ژن به طور مختصر مرور خواهد شد.
۱- مقدمه ای بر رسانش ژن:
ژن درمانی به عنوان روش بالقوهای برای درمان ناهنجاریهای ژنتیکی و سایر بدخیمیها در سالهای اخیر توجه بسیاری را به خود جلب کرده است. در ژن درمانی پلاسمید DNA (پلاسمیدها معمولاً به شکل یک مولکول DNA دورشتهای حلقوی هستند (هرچند انواع خطی پلاسمید نیز وجود دارد) که همانند سازی آنها بطورمستقل از هسته انجام میگیرد.) برای بیان پروتئین درمانی خاص و یا الیگونوکلوتیدهایی برای برای خاموش کردن ژن ایجادکننده بیماری (Antisense Therapy )بکار میروند. تزریق مستقیم DNA خالص (Naked DNA ) امکان پذیر است ولی سلولهای کمی DNA را برداشت کرده و احتمال کمی وجود دارد که منجر به تولید پروتئین شود. اهمیت اصلی پلاسمید DNA خالص برای توسعه و تولید واکسن است که مقدار کمی از پروتئین میتواند منجر به ایجاد پاسخ ایمنی دلخواه شود. در اغلب موارد استفاده از DNA خالص برای انتقال مواد ژنتیکی در شرایط درون تن (In Vivo )مناسب نیست و این امر به علت تخریب DNA به وسیلهی نوکلئازهای سرم است.بنابراین معمولا یک سیستم حامل توصیه میشود که بایستی زیستسازگار (Biocompatible) و غیر ایمنیزا (Non Imonogenic ) باشد، از DNA در مقابل عوامل سیستم رتیکواندوتلیال (RES= Reticuloendothelial system) حفاظت کند و برای سلول یا بافت هدف ویژه باشد.
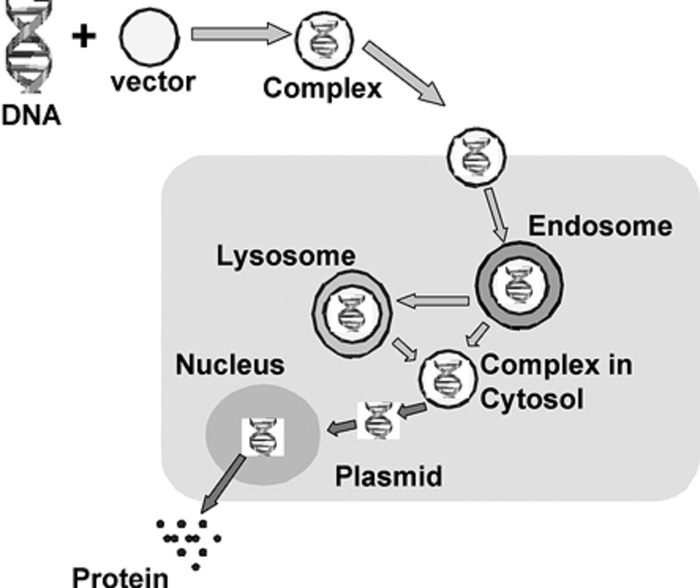
شکل ۱-شکل شماتیک موانع بیولوژیکی که بایستی حامل انتقال ژن برآنها غلبه کند.
انتظار میرود که فرآیند ورود حامل نانویی به سلول آندوسیتوز باشد، بنابراین سیستم حامل بایستی توانایی فرار آندوزمی و رسانش DNA به هسته را داشته باشد.همانطوریکه در شکل ۱ دیده میشود یک سیستم خوب بایستی حاوی انواع اجزا ساختمانی برای رفتار های ویژه باشد.
کاربردهایی بالینی ژنداروها به علت ناپایداری آنها در مایعات بدن و برداشت کم بافتی آنها که در نتیجهی وزن مولکولی بالای آنها و باردار بودن اسید های نوکلئیک است، رشد چشمگیری نداشته است. بنابراین طراحی یک سیستم رسانش مناسب که بتواند DNA یا رشتهی اولیگونوکلوتیدی را به هدف مورد نظر برساند ضروری است.دو روش کلی برای نایل شدن به این هدف وجود دارد: ۱٫ استفاده از حامل های ویروسی و ۲٫ حامل های غیر ویروسی. علیرغم کارایی بالای حامل های ویروسی برای انتقال DNA به گسترهی وسیعی از سلولها،ایجاد مشکلات عمده از جمله خطر ایجاد پاسخ ایمنی به حامل ویروسی و نیز امکان اختلاط اتفاقی حامل ویروسی با ویروس دست نخوردهی اصلی (Wild Type Viruses) وجود دارد. بنابراین نیاز به یک حامل مطمئنتر برای رسانش DNA وجود دارد. این حامل بایستی دانسیتهی بار سطحی و هیدروفوبیسیتهی لازم برای بر همکنش با اجزای لیپیدی سلول و نیز DNA را داشته باشد.
به سبب بار ذاتی منفی DNA(که به علت وجود گروههای ساختاری فسفات است) معمولا از موادی با بار مثبت به عنوان حامل برای رسانش DNA استفاده میشود تا با استفاده از برهمکنش الکترواستاتیک بتوان حامل را به DNA متصل کرد(شکل۲). پلیمرهای کاتیونی و فسفولیپیدهای کاتیونی دو نوع اصلی حاملهای رسانش ژن غیر ویروسی حال حاضرند که مورد بررسی قرار میگیرند. به علت بار سطحی مثبت، هر دو نوع با DNA منفی به صورت الکترواستاتیک واکنش داده و ترکیب میشوند.
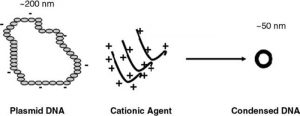
شکل ۲- شکل شماتیک فرایند برهمکنش حامل پلیمری با بار مثبت با DNA منفی با اندازه ۲۰۰ نانومتر
علیرغم ساخت راحت ترکیبات لیپیدی، انتقال ژن پایین و سمیت اکثر آنها، باعث محدودیت استفاده از آنها میشود. ترکیبات پلیمری کاتیونی اغلب پایدار تر از ترکیبات لیپیدی کاتیونیاند، ولی به طور کلی در مقایسه با حاملهای ویروسی، انتقال ژن کمتری دارند. این حاملها با DNA ترکیبی پلی الکترولیت می سازند و آن را از تخریب نوکلئازی حفاظت میکنند. این حاملهای پلیمری تطبیقپذیری و تغییرپذیری ساختاری مناسبی دارند که امکان متصل کردن اجزائ خاص برای هدفمند کردن حامل در بیان ژن از طریق گیرندههای خاص را فراهم می کنند. مطالعاتی بر روی سایر نانوساختارها برای انتقال DNA صورت گرفته است که در مقاله بعدی مورد بررسی قرار میگیرند.
انتقال موفق DNA به وسیله مشکلات زیر محدود میشود.
الف: هدفمند کردن سیستم رسانش برای سلولهای خاص،ب: انتقال از غشاء سلول،ج: برداشت توسط سلول و تخریب در آندوزم ها و د: انتقال داخل سلولی پلاسمید DNA تا هسته
۲- نانوذرات برای انتقال ژن و دارو
در سال ۱۹۷۰،Speiser و همکارانش برای اولین بار، ذرات کلوئیدی با قطر کمتر از یک میکرومتر را که حاوی ترکیبات ماکرومولوکولی بودند ساختند. از آن زمان به بعد کارهای بسیار زیادی در زمینه استفاده از نانوذرات برای دارورسانی و ژن رسانی صورت گرفته است. در ابتدا بیشتر نانوذرات به عنوان حامل واکسن و داروهای ضد سرطان طراحی شدند. البته استفاده از این حاملها برای امکان بکارگیری داروها و واکسنها به صورت خوراکی و چشمی در حال حاضر در دست بررسی است.
دارو ها و یا سایر مولکولهای فعال بیولوژیکی در داخل نانوذرات بدام انداخته و یا کپسوله می شوند و یا اینکه به صورت شیمیایی به نانوذرات متصل و یا به سطح ذرات جذب میشوند. انتخاب روش مناسب برای آمادهسازی داروی حمل شده توسط نانوذره بستگی به خواص دارو و نانوذره دارد. دو نوع مختلف سیستم با ساختار داخلی متفاوت امکانپذیر است.
۱٫ سیستمهایی از نوع ماتریسی که از در هم پیچیده شدن اولیگومرها و یا واحد های پلیمری تشکیل میشوند که به نانواسفر یا نانوذره معروفاند.
۲٫ سیستمهای از نوع ذخیرهای که حاوی هستهی پوشیده شده با دیوارهی پلیمری هسنتدو به عنوان نانوکپسول تعریف میشوند.
سیستمهای کلوییدی مختلف برای دارورسانی و یا ژن رسانی در شکل ۳ نشان داده شده است.
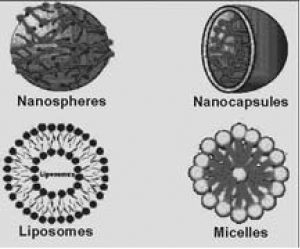
شکل ۳-ساختارهای مختلف نانوذرات مورداستفاده درکاربردهای دارویی انتقال ژن
۳- نانوذرات غیرویروسی در حال بررسی و گسترش
۱-۳- کیتوزان
کیتین فراوانترین آمینوپلیساکارید طبیعی استو در دیوارهی سلولی قارچها و اسکلت خارجی سختپوستانی مثل خرچنگ ها و میگوها و نیز در حشرات دیده میشود. تخمین زده میشود که تولید سالیانهی آن به اندازهی سلولز باشد. کیتین بسیار مورد توجه است البته نه به خاطر اینکه منبعی در دسترس است بلکه به علت پتانسیل بسیار بالایی که در کاربرد های مختلف دارد. کیتوزان، آمینو پلیساکاریدی است که از داستیلاسیون کیتین در شرایط قلیایی بدست میآید و بسیار شبیه سلولز است(شکل ۴).کیتوزان یک پلیمر زیست سازگار غیر سمی است که کاربردهای بسیاری در دارورسانی و اخیرا در ژن رسانی دارد.
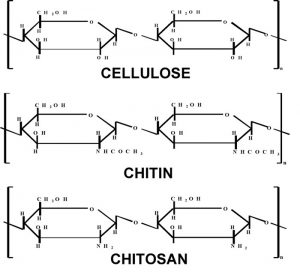
شکل۴-شباهتهای ساختاری بین سلولز،کیتین،وکیتوزان
MacLaughlinو همکارانش از کیتوزان و الیگومرهای دپلیمریزه شدهی کیتوزان برای رسانش پلاسمید در شرایطدرون تن استفاده کرده است.برای ساخت حاملهای حاوی پلاسمید، اولیگومرهای کیتوزان و یا پلیمر آن در داخل اسید استیک سونیکه میشوندومحلول حاصل را با فیلتراسیون استریل کرده تا نانوذرات با اندازه بزرگتر از ۲۰۰ نانومتر پاک شوند. محلول حاصل به مدت ۵-۳ دقیقه به شدت به هم زده می شود و سپس برای ۳۰ دقیقه در دمای اتاق رها میشود تا ترکیب ذره با پلاسمید به خوبی صورت گیرد. انتقال ژن در شرایط برون تن با سلولهای Cos-1 صورت گرفت و مطالعات درونتن نیز بر روی بافت رودهای انجام شد. میزان بالایی از بیان ژن در فرمولاسیون کیتوزان-پلاسمید نسبت به DNA خالص در قسمت فوقانی رودهی کوچک مشاهده شد. در این مطالعه پارامترهای تاثیر گذار بر اندازهی ذرهای و پایداری سیستم حامل، وزن مولکولی کیتوزان ، غلظت پلاسمید و نسبت بار تعیین شد. نشان داده شد که ترکیب پلاسمید و کیتوزان با وزن مولکولی بالا در مقابل نمک و چالشهای ناشی از برهمکنش با سرم پایدارتر است.در مطالعه دیگری، جزئیات کیتوزان به عنوان یک حامل انتقال ژن، در مطالعات برونتن و درونتن به وسیلهی Leong و همکارانش بررسی شد. در یکی از مطالعات این گروه، آنها پارامترهای موثر بر اندازه ذره و خصوصیات فیزیکوشیمیایی نانوذرات را بررسی کردند و حفاظت DNA توسط کیتوزان را اثبات کردند. آنها همچنین نانوذرات کیتوزان پگیله شده (پوشانده شدن نانوذرات توسط پلیمر پلیاتیلن گلیکول )(شکل ۵) را به منظور بهبود پایداری نگه داری و نیز بهبود بازده فرمولاسیون بررسی کردند. توزیع بافتی نانوذرات کیتوزان حاوی DNA و نانوذرات کیتوزان حاوی DNAپگیله شده بررسی و مشاهده گردید که پاکسازی نانوذرات پگیله شده در ۱۵ دقیقه اول بسیار کند تر بود. بایستی ذکر شود که کارایی انتقال ژن به نوع سلول نیز بستگی دارد. Sato و گروهش متوجه شدند که کارایی انتقال ژن در کیتوزان به وزن مولکولی،pH محیط کشت، سرم و استوکیومتری سیستم طراحی شده بستگی دارد.
۲-۳- لیپوزمها
Felgner و همکارانش اولین کسانی بودند که لیپید کاتیونیDOTMA= Dioleyltrimethylammoniumchloride را با لیپید خنثیDOPE= Dioleoylphosphatidyl-ethanolamine ترکیب و از آن به عنوان حامل انتقال DNA استفاده کردند. از آن به بعد انواع مختلفی از ترکیبات لیپیدی به عنوان حامل انتقال ژن بکار گرفته شدند. به سبب طبیعت دوگانه دوست(Amphiphilic ) ، این لیپید ها به راحتی در آب تشکیل میسل میدهند و به علت بار مثبت به سرعت و با کارایی بالا با DNA برهمکنش میدهند. لیپوزمهای کاتیونی از تبخیر حلال آلی از مخلوطحاوی لیپید کاتیونی و سپس آبپوشی فیلم لیپیدی حاصل در محیط آبی تحت شرایط همزدن شدید تهیه میشوند که منجر به ساخت وزیکول های چند دیواره (MLVs= Multi layer vesicles) میشود. وزیکولهای تک دیواره نیز از سونیکه کردن و یا استخراج(Extraction ) وزیکولهای چند دیواره بدست میآیند. اضافه کردن DNA به لیپوزوم کاتیونی باعث تغییرات شگرفی در لیپوزوم و DNA میشود. این امر باعث تغییر ساختار اولیه لیپوزوم و ایجاد ساختاری تطبیق یافته میشود. نتایج برخی از محققان نشان میدهد که تغییر مشخصات سطحی لیپوزوم ها باعث بهبود توزیع زیستی و نیز رسانش هدفمند DNA با لیپوزوم میشود. ساختار بعضی از لیپیدهای کاتیونی مورد استفاده در رسانش DNA در شکل ۵ نشان داده شده است.
به نظر میرسد یک سیستم به تنهایی نتواند کارایی خوبی در انتقال DNA به هسته داشته باشد،از این روOku و همکارانش روش ژن رسانی جدیدی را گزارش کردند که نام سیستم لیپوزومی پلیکاتیونی (PCL= polycation liposome system)را بر آن نهادند. آنها با اضافه کردن پلی کاتیون پلی اتیلن ایمین (polycation liposome system (PCL)) با لیپوزوم،PCL را ساخته اند. PCL حاصل نیازی به فسفاتیدیل اتانل آمین و یا کلسترول به عنوان اجزا یک لیپوزوم معمول ندارد. این محققان، تاثیر وزن مولکولی PEI را نیز در ژن رسانی در این روش بررسی کردند.نتایج آنها نشان داد که PEI با وزن مولکولی پایین از PEI با وزن مولکولی بالا در ژن رسانی برون تن، موثرتر است. محققان دیگر کارایی این روش را در ژن رسانی درون تن اثبات کردند.
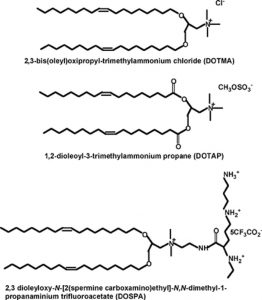
شکل ۵- برخی از لیپید های کاتیونی مورد استفاده در ژن رسانی
Huang و همکارانش با ترکیب لیپید های کاتیونی با پلی لیزین (poly-L-lysine =PLL) حامل مناسبی را برای ژن رسانی توسعه دادهاند.Szoka پروتکلی را برای بررسی توزیع بافتی و کارایی ژن رسانی از طریق ترکیبات لیپیدی فلورسانس در مقاطع بافت ریه معرفی کرده اند.Baraldo و همکارانش از لیپوزوم های بر پایهی اسفنگوزین ساخت یک حامل ژن رسانی عضلانی را گزارش کردند.
۳-۳- ذرات چربی جامد (SLN= Solid Lipid Nanoparticles)
Müller و همکارانش از نانوذرات چربی جامد به عنوان حامل انتقال ژن استفاده کرده اند. آنها پی بردهند که SLN علاوه بر انتقال دارو میتواند حامل مناسبی برای انتقال DNA پلاسمیدی نیز باشد.
این گروه از طریق تکنیک هموژناسیون داغ (hot homogenization technique)نانوذرات چربی جامد به شدت کاتیونی با پتانسیل زتای بیشتر از ۴۰+ و اندازهی ۱۰۰ نانومتر را تولید کردند. آنها پی بردند که نانوذرات چربی جامد بعد از اتصال با DNA پلاسمیدی با یکدیگر ترکیب شده و تولید ذرات بزرگتری را میکنند که اندازهای در حدود ۳۰۰ تا ۸۰۰ نانومتر دارند(شکل ۶) . کارایی انتقال ژن این حامل در شرایط برون تن در ردهی سلولی Cos-1 نشان داده شده است.
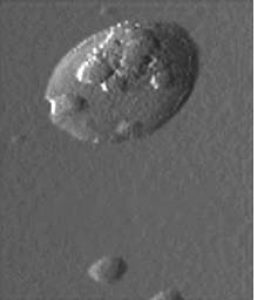
شکل ۶ – نانوذرات چربی جامد به همراه DNA پلاسمیدی (نیمه فوقانی) که از ترکیب چندین ذره ی کوچک تر درست شده اند. یک ذره ی کوچک در پایین تصویر دیده می شود.
بحث و نتیجه گیری
به دلیل بروز مشکلاتی که بر سر راه ورود یا پس از ورود DNAی تنها به بدن ایجاد شد، تفکرات بشری به سمت استفاده از حاملهایی رفت که علاوه بر هدفمند بودن، زیست سازگار و غیر ایمنی زا بوده و از DNA در مقابل سیستم رتیکواندوتلیال محافظت کنند و توانایی فرار آندوزمی و رسانش DNA به هسته را نیز داشته باشند. لذا استفاده از حاملهای ویروسی وغیرویروسی، مورد بررسی قرارگرفت که با توجه به مشکلات موجود برای استفاده از حاملهای ویروسی انواع غیر ویروسی در اولویت بررسی قرارگرفتند. در ابتدا ذرات کلوئیدی در ابعاد ماکرو و سپس این ذرات به صورت حاملهای به شکل نانواسفر و نانوکپسول تهیه شدند.انواع حاملهای غیرویروسی تحت بررسی که در این مقاله به آنها اشاره شد، شامل کیتوزان، لیپوزومها و نانوذرات چربی جامد می باشند. هر یک از نانوحاملها توسط گروه های تخصصی مختلفی مطالعه شده و در مطالعات برونتن و درونتن به صورت خالص یا اصلاح سطح شده منجر به نتایج امیدوارکننده ای شدند.
منبع : edu.nano.ir